ctDNA早于影像学提示食管鳞癌放化疗后进展
【IF 8.6】ctDNA早于影像学提示食管鳞癌放化疗后进展

导读
对于局部晚期食管鳞癌(ESCC),新辅助放疗/放化疗(neo-RT/CRT)后再手术,或根治性放疗/放化疗(RT/CRT),是目前临床上的标准治疗方式。然而单纯依赖影像学方法无法准确地评估患者放化疗疗效。既往研究表明ctDNA是食管鳞癌患者预后及复发监测的有效标志物,但其对于治疗开始后,患者的早期复发/转移检测潜力,以及预后预测的价值仍然需要进一步研究。
中国医学科学院肿瘤医院毕楠教授、王鑫教授、李印教授团队合作,前瞻性对接受根治性放化疗的ESCC患者进行ctDNA动态监测评估与预后的相关性,结果证实ctDNA可早于影像学4.4个月提示进展。相关研究成果发表在Clinical and Translational Medicine(IF=8.554)。
研究亮点
1、前瞻性研究,揭示食管鳞癌放化疗患者ctDNA动态变化特征。
2、ctDNA动态监测可早于影像学4.4个月提示疾病进展。
3、在四个不同时间点分别采集患者外周血,分析ctDNA的动态变化与预后的相关性,明确了放疗第四周ctDNA对局部复发风险的预测价值。
研究设计
本研究共纳入42例II-IVb期初治食管鳞癌患者,分别在基线、放化疗第4周、放化疗后1-3个月、放化疗后3-6个月4个时间点(T0-T3)采集血浆样本进行瑞递康®放疗大Panel检测(图1)。治疗开始后第4周评估患者是否可进行食管切除术,对于不符合根治性手术条件的患者,继续行根治性放疗/放化疗。
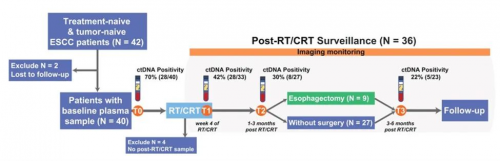
图1. 研究路线
研究结论
RT/CRT治疗开始后ctDNA状态可预测预后
根据基线ctDNA状态对患者进行分层。尽管基线ctDNA阴性比阳性无进展生存期(PFS)和总生存期 (OS)呈现更优趋势,但两者均未达到统计学意义。这意味着,基线ctDNA不能成为RT/CRT治疗的ESCC患者预后生物标志物。
对治疗开始后三个时间点的ctDNA状态作进一步分析发现,ctDNA阳性患者均与更差的PFS和OS显著相关(图2)。结合临床进行多因素分析发现,放疗第四周(T1)ctDNA状态是PFS的独立预测因素。
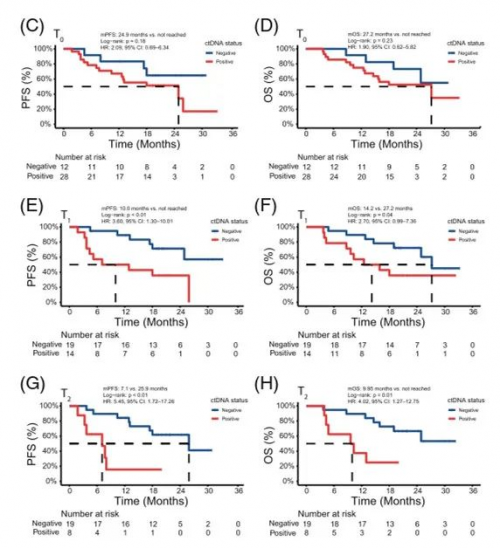
图2. 随访时间点ctDNA状态与预后生存曲线
放化疗第四周ctDNA状态提示局部复发风险
放化疗第四周ctDNA阳性患者,有显著更高的局部复发风险(LRFS)(p=0.01,图3A)。进一步评估发现,ctDNA阳性患者均未接受食管切除术,19例ctDNA阴性患者中仅有6例接受了食管切除术。根据ctDNA状态及是否接受手术对患者进行分层,三个亚组之间LRFS有显著差异,特别是接受食管切除术且ctDNA阴性的6例患者有显著更好的无局部复发生存(p=0.02,图3C)。
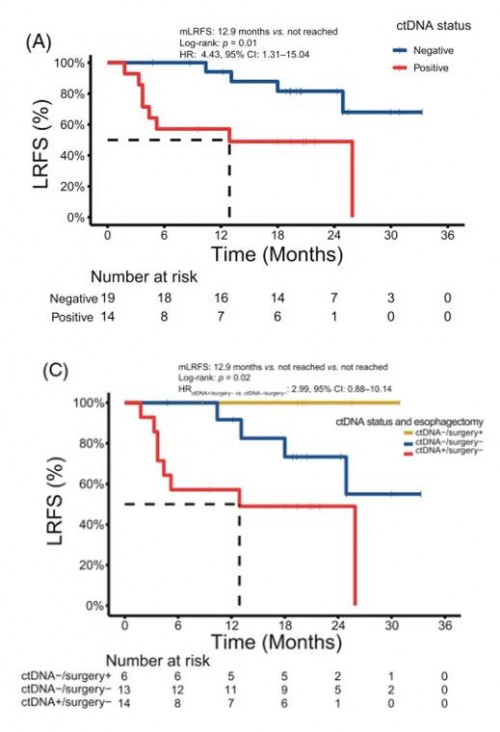
图3. 放疗第四周ctDNA状态与局部复发风险
ctDNA的动态变化具有预后预测价值
通过ctDNA动态变化同样可以预测患者预后。对33例同时有T0和T1时间点血浆样本的患者进行分析,ctDNA持续阴性的患者比ctDNA浓度下降的患者有更好的PFS(p=0.06,图4B);在21例ctDNA浓度下降的患者中,与未达到ctDNA清零的患者相比,ctDNA清零患者有更好的PFS(p=0.06,图4C)。
对27例同时有T0和T2时间点血浆样本的患者进行分析,得到相似的结论,ctDNA持续阴性的患者比ctDNA浓度下降和ctDNA浓度升高的患者有更好的PFS(图4D);同样的,ctDNA清零的患者有显著更好的PFS(p<0.01,图4E)。
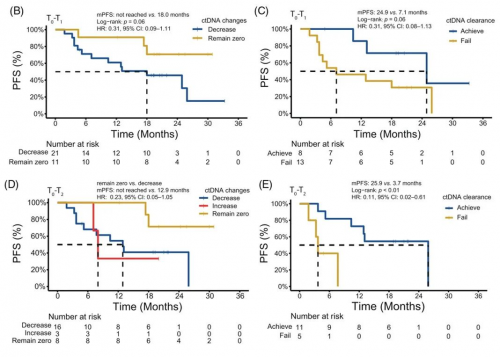
图4. ctDNA动态变化特征对预后的提示
注:ctDNA浓度=cfDNA浓度*最大突变丰度
ctDNA可早于影像学4.4个月提示进展
对36例患者进行动态监测分析(4例治疗后未进行ctDNA检测),其中16例患者(16/36,44.4%)在随访结束时影像学提示进展(图5)。36例患者中有11例至少1次检测到ctDNA阳性(包含9例基线时ctDNA阳性)。ctDNA检测阳性比影像学进展,中位提前时间为4.4个月。
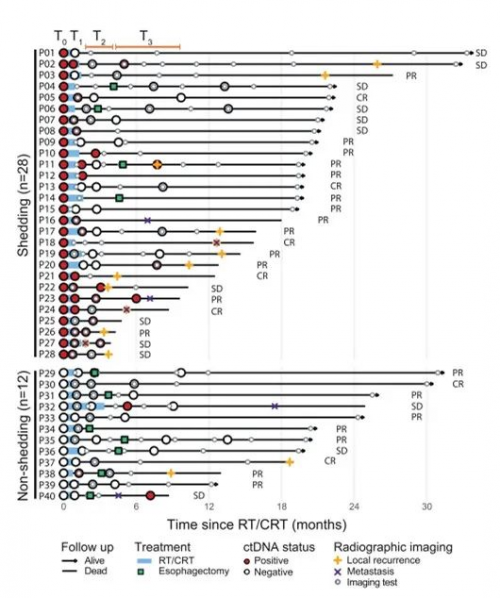
图5. ctDNA对于食管鳞癌患者早期进展的提示
结语
本研究前瞻性对42例接受放化疗的食管鳞癌患者进行ctDNA动态监测,发现:【1】放化疗第四周的ctDNA阳性提示患者较高的局部复发风险;【2】ctDNA动态变化特征也可以用于预测预后;【3】ctDNA可早于影像学4.4个月提示疾病进展。本研究表明ctDNA动态监测可精准指导食管鳞癌患者放化疗的临床获益。
本研究使用了世和基因瑞递康®放疗大Panel检测技术。
参考文献
1. Clin Transl Med. 2022;12(11):e1116. doi:10.1002/ctm2.1116.
2. Future Oncol. 2010 Jan;6(1):25-35. doi: 10.2217/fon.09.133.
3. Cancer Discov. 2014 Jun;4(6):650-61. doi: 10.1158/2159-8290.CD-13-1014.
4. Gastroenterology. 2020 Feb;158(3):494-505.e6. doi: 10.1053/j.gastro.2019.10.039. Epub 2019 Nov 9.
发表评论




暂时没有评论,来抢沙发吧~