II期临床:TMB及克隆分析揭示食管癌免疫新辅获益新方向
【IF 12.5】II期临床:TMB及克隆分析揭示食管癌免疫新辅获益新方向

导语
食管癌是中国高发的恶性肿瘤之一,其中约90%为食管鳞癌(ESCC)。大部分ESCC患者在确诊时即为局晚期,新辅助放/化疗联合手术是标准治疗方案,但整体的有效性和安全性相对较差,因此,临床亟需更优治疗方案来改善ESCC患者的预后。通过筛选疗效生物标志物有望进一步优化治疗决策。
江苏省人民医院顾艳宏教授、骆金华教授团队合作开展的KEEP-G 03研究,证实信迪利单抗联合三药化疗的新辅助治疗方案在II-IVA期可切除ESCC患者中具有良好的抗肿瘤疗效和安全性。研究发现:肿瘤突变负荷(TMB)和主克隆性突变越多,患者病理缓解率越高;而ERBB2突变则与更低的病理缓解相关,ctDNA阴性患者更倾向获得完全病理缓解。相关研究成果已发表国际权威期刊Journal for ImmunoTherapy of Cancer (IF=12.469)。
研究亮点
1、证实信迪利单抗联合化疗新辅助治疗在II-IVA期可切除ESCC患者中具有良好的抗肿瘤疗效和安全性;
2、首次发现TMB及主克隆性突变在ESCC新辅助免疫治疗中的预测价值;ERBB2突变是ESCC新辅助治疗疗效不佳的生物标志物;
3、进一步拓展了ctDNA的临床应用范围,基线ctDNA阴性ESCC患者可提示更佳的新辅助疗效。
研究设计
KEEP-G 03研究是一项开放标签、单臂、II期、探索性临床试验,计划入组可切除(cT1b-3, Nany, M0或T4a, N0-1, M0)ESCC患者,在手术前接受两个周期的信迪利单抗联合三药化疗(脂质体紫杉醇/顺铂/S1)治疗,新辅助治疗结束后行食管切除术。研究的主要终点安全性和手术可行性;次要终点包括主要病理缓解(MPR)率、R0切除率等;探索性终点,研究定义MPR患者为响应患者(responder),未获得MPR的患者为无响应患者(Non-responder),分别从PD-L1、基因变异、TMB、ctDNA状态、免疫微环境等多个角度探索新辅助免疫治疗生物标志物。
研究结果
新迪利单抗联合三药化疗新辅助治疗疗效显著且安全可控
研究最终入组30例ESCC患者接受治疗,均接受了手术且全部实现R0切除。3-4级治疗相关不良反应(TRAEs)发生率36.7%,最常见的不良反应包括白细胞减少,贫血等。50%患者获得MPR,20%患者获得完全病理缓解(pCR)(图1A)。中位无复发生存期(RFS)及中位总生存期(OS)均未达到。值得注意的是,所有达到pCR的患者均存活且尚未复发。此外,在COVID-19流行期间,10例ESCC患者预先接受了粒细胞集落刺激因子(G-CSF)治疗。事后分析显示这部分患者pCR率显著高于未接受G-CSF治疗的患者(50% vs 5%,p=0.0088,图1B)。
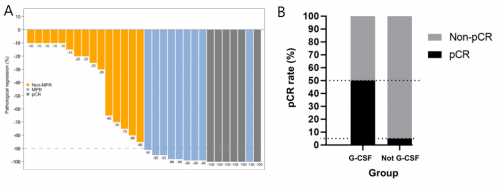
图1. ESCC患者肿瘤病理缓解瀑布图(A);预防性使用G-CSF与pCR的相关性(B)
TMB和主克隆性突变越高,新辅助免疫治疗疗效越好
本研究对25例患者基线组织样本进行PD-L1表达及NGS大Panel检测发现,PD-L1表达与病理缓解相关性较弱(PD-L1 CPS ≥ vs <1:66.7% vs 37.5%,p=0.23,图2A)。整体上,响应患者较无响应患者TMB倾向更高(mTMB 12.69 vs. 8.46 muts/Mb,p=0.08,图2B),且TMB越高,患者缓解率越高(图2C)。进一步区分主克隆性突变表明:与无响应的患者相比,有响应的患者克隆性突变倾向更多(中位数6.0 muts vs 3.0 muts,p=0.08,图2D)。ROC分析表明:基于克隆性突变对新辅助免疫治疗疗效的预测价值优于TMB,其AUC为0.76,TMB为0.69(图2E)。
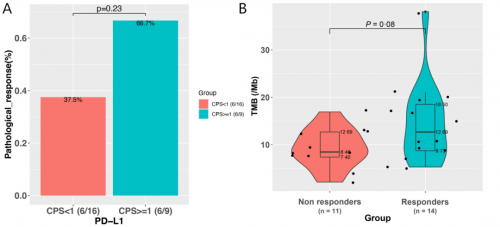
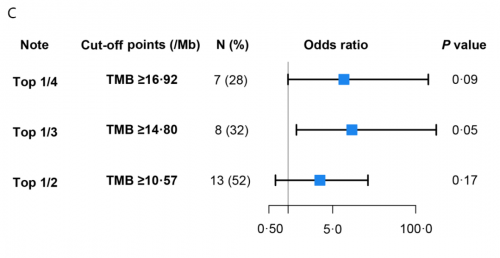

图2. PD-L1、TMB和克隆性突变与新辅助免疫联合治疗疗效相关性分析(N=25)
ERBB2突变与新辅助免疫联合治疗疗效不佳相关
基因变异与新辅助疗效探索分析发现,ERBB2突变患者较野生型患者相比响应率倾向更低(0% vs 63.6%,p=0.07,图3A),3例ERBB2患者均无响应。基因互作分析显示,ERBB2突变与其他基因突变无关联。ERBB2与TMB的关联性分析提示:两例TMB-H(TMB≥10muts/Mb)患者新辅助治疗无响应可能因ERBB2所致(图3B)。

图3. ERBB2突变新辅助免疫联合治疗疗效相关性分析
基线ctDNA阴性状态可能提示更高的完全病理缓解率
研究对30例ESCC患者基线血浆样本进行NGS测序来探索ctDNA状态与新辅助免疫联合治疗之间的关系。结果显示,尽管响应患者和无响应患者之间ctDNA阴性比例无差异(33.3% vs 13.3%,p=0.39),但进一步区分pCR vs Non-pCR时,获得pCR的患者ctDNA阴性比例显著更高(83.3% vs 8.3%,p=0.008,图4)。
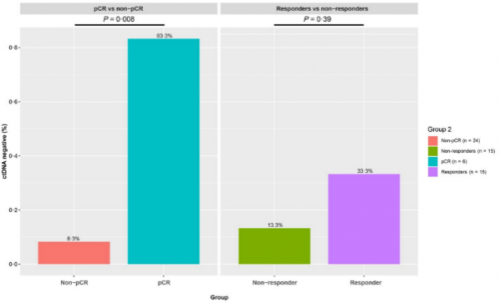
图4. ctDNA状态与新辅助免疫联合治疗疗效相关性分析
M2巨噬细胞浸润可能提示新辅助疗效不佳
为评估免疫微环境和病理缓解的潜在关联,研究对26例患者的肿瘤基线组织样本进行了多重免疫荧光(mIHC)染色,主要包括T细胞,巨噬细胞和NK细胞,3例样本未通过质控。研究根据肿瘤区域的免疫微环境成分(TIME)进行无监督聚类,将患者分为三个不同的亚组(CT1、CT2和CT3,图5A)。CT1中CD8+ T细胞浸润较多,CT3中M2型巨噬细胞浸润较多,而CT2中免疫细胞浸润较低。与CT1或CT2组相比,CT3组pCR的患者(CT1,28.5%;CT2,16.67%和CT3,0.0%,p=0.62)和响应患者(CT1,57.14%;CT2,58.34%和CT3,0.0%,p=0.17)均为0%(图 5B),这意味着M2型巨噬细胞与疗效不佳相关。
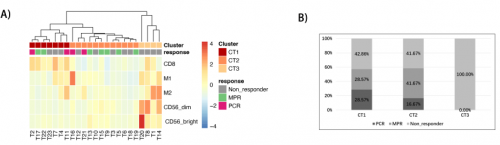
图5. 肿瘤免疫微环境与新辅助免疫联合治疗疗效之间的关系
结语
本研究结果初步证明信迪利单抗联合三药化疗作为可切除食管鳞癌患者新辅助治疗方案的可行性,未来期待进一步扩大样本研究。基于分子层面及免疫微环境等层面的探索,有望进一步细化和富集食管癌新辅助免疫治疗优势人群,为ESCC新辅助治疗方案的选择提供更多的临床依据。
本研究使用了世和基因泛实体瘤NGS大Panel世和一号®检测技术。
参考文献
Zhang Z, Ye J, Li H, Gu D, Du M, Ai D, Chen W, Fang Y, Xu X, Bai C, Zhao K, Zhou G. Neoadjuvant sintilimab and chemotherapy in patients with resectable esophageal squamous cell carcinoma: A prospective, single-arm, phase 2 trial. Front Immunol. 2022 Oct 13;13:1031171. doi: 10.3389/fimmu.2022.1031171. PMID: 36311804; PMCID: PMC9606329.
发表评论




暂时没有评论,来抢沙发吧~